SINIF:7
ÜNİTE:4
KONULAR:
1-ELEMENTLER VE SEMBOLLERİ
2-ATOMUN YAPISI
3-ELEKTRONLARIN DİZİLİMLERİ VE KİMYASAL ÖZELLİKLERİ
4-KİMYASAL BAĞ
5-BİLEŞİKLER VE FORMÜLLERİ
6-KARIŞIMLAR
-
MADDENİN YAPISI ve ÖZELLİKLERİ
Tarih boyunca insanlar maddenin yapısını merak ederek araştırmış maddenin özü nelerden yapıldığı konusunda tezler ortaya atmışlardır. Bu konuda ilk fikir M.Ö. Democritus tarafından ortaya atılan "Herhangi bir madde sürekli olarak ikiye bölünecek olursa en sonunda bölünemeyen bir parça elde edilir." fikridir. Democritus bu bölünemeyecek parçaya bölünemeyen anlamında ATOM adını vermiş ve maddenin yapıtaşını atom olarak adlandırmıştır. Daha sonra Daltonatomun bölünemez içi dolu yapılar olduğunu ve her maddenin farklı atomu olduğunu göstermiştir.
Günümüz teknolojisinde atom bölünebilmesine rağmen aynı ad kullanılmaya devam .edilmektedir
Doğada bilinen tüm maddeler taneciklerden oluşmuştur. En küçük yapıtaşları atomdur. Atomlar ancak elektron mikroskobu ile görülebilen çok küçük küresel taneciklerdir. Maddeyi oluşturan atomlar arasında boşluklar bulunabilir.
Günümüz teknolojisinde atom bölünebilmesine rağmen aynı ad kullanılmaya devam .edilmektedir
Doğada bilinen tüm maddeler taneciklerden oluşmuştur. En küçük yapıtaşları atomdur. Atomlar ancak elektron mikroskobu ile görülebilen çok küçük küresel taneciklerdir. Maddeyi oluşturan atomlar arasında boşluklar bulunabilir.

SAF MADDE: Kendisinden başka madde bulundurmayan maddelere denir.
1-Elementler ve sembolleri
Bilim insanları, eski çağlarda, doğadaki her şeyin dört temel elementten meydana geldiğine ve bu elementlerin “hava, su, toprak ve ateş” olduğuna inanırlardı. Bu dört elementi yanda görülen farklı biçimlerde çizilmişler,
üçgenlerle göstermişlerdi. Sizce, şekillerle gösterim, onlara ne gibi kolaylıklar sağlamış olabilir? Bu dört elementin farklı şekillerde bir araya gelmesi sonucu farklı maddeleri oluşturduğunu düşünüyorlardı. Milattan
önce başlayan bu düşünce Orta Çağ sonuna kadar hüküm sürdü. Bu dönem, dünyan›n pek çok yerinde özellikle Avrupa’da büyücülerin, falcıların, batıl inançların kol gezdiği bir dönemdi. Baz› insanlar bu dönemde simya olarak adlandırılan uğraşılarla tüm maddeleri altına dönüştürmeye çalışmışlardı. Böyle bir ortamda Robert Boyle (Rabırt Boyl), elementi “daha basit maddelere ayrılamayan madde” olarak tanımlamış ve dört temel element kavramının yanlış olduğunu savunmuştu. Sizce hava, su, toprak ve ateş neden element olarak kabul edilmemiştir?
“Simya” adı altında sürdürülen çalışmaların kimya bilimine dönüşmesi 18. yüzyılın sonlarına rastlamaktadır. Bu dönemdeki araştırmalar sonucunda birçok yeni element keşfedilmiş ve günümüzde bilinen element kavramının temeli oluşturulmuştur.
Elementlerin tüm özelliğini gösteren en küçük parçasına atom denir.
Elementi oluşturmak için aynı tür atomlar bir araya gelir. Bir elementin bütün atomları birbiriyle aynı iken, farklı elementlerin atomları birbirinden farklıdır. Bu elementlerin her biri farklı özelliklere sahiptir. Örneğin karbon elementini oluşturan atomlar birbiriyle aynı iken, azot elementini oluşturan atomlardan farklıdır. Bu sebeple demir elementi, bakır elementinden farklı özelliklere sahiptir.

Doğada canlı ve cansız her madde elementlerden oluşmaktadır. Bazı elementlerin
adlar›n› besinlerimizden veya kullandığımız malzemelerden dolayı sıkça duyarız. Fakat
bunların element olup olmadıklarını herhalde bugüne kadar hiç düşünmemişizdir. Aşağıda
günlük hayatta karşılaştığımız yaygın elementler, bu elementlerin tanecikli yapı modelleri
ve baz› kullan›m alanlar› bir arada verilmiştir.
Altın ve gümüş elementleri, süs eşyası olarak kullanılırlar.Altın,gümüş elementi yüzük,kolye vb.
Yediğimiz besinler de elementlerden oluşmaktadır.İyot elementi deniz ürünlerinde ve iyotlu sofra tuzunda bol miktarda bulunmaktadır.
Kalay elementi güğümlere parlaklık katar.
Aşağıda bazı elementler ve kullanım alanları verilmiştir:
1. Hidrojen (H):
Ticari gübrelere azot bağlanmasında, katı ve sıvı yağların doyurulma işleminde kullanılır. Kaynak yapımında, hidrojen balonlarını şişirmede ve petrolün işlenmesinde kullanılmasının yanında, şimdilik daha çok roketlerde olmak üzere yakıt olarak da kullanılır.
2. Helyum (He):
Zeplin ve balon gibi hava taşıtlarını şişirmede kullanımıyla bilinen helyum gazı; kaynakçılıkta, germanyum ve
silisyum kristallerinin yapımında, titanyum ve zirkonyum eldesinde, rüzgar tünellerinde ve derin dalış tüplerinde de kullanılır. Ayrıca, düşük sıcaklık araştırmalarında ve nükleer enerji santrallerinde "soğutucu" olarak da önemlidir.
3. Lityum (Li):
Seramik ve cam yapımında, pil üretiminde, yağlayıcı ve alaşım sertleştirici maddelerin bileşiminde, A vitamini sentezinde, nükleer santrallerde soğutucu görevinde ve roketlerde itici kuvvet sağlamada kullanılı
4. Berilyum (Be):
6. Karbon (C):
Birçok bileşiğin yapısına giren karbon, sıvı yağların dehidrasyonunda (sudan arındırılmasında), ayrıca demir ve alaşımlarının işlenmesinde kullanılır.
Standart sıcaklık ve basınç altında son derece kararlı olan ve atmosferin %78'ini oluşturan azot gazı, besinlerin ve kimyasalların saklanmasında kullanılır.
8. Oksijen (O):
Bitkilerin ve hayvanların yaşamlarını devam ettirebilmeleri, solunum gazı olan oksijenin (O2) varlığına bağlıdır. Atmosferin %21'i, oksijen gazından oluşmaktadır. Hastanelerde, solunum rahatsızlıkları gösteren hastaların tedavisi için de oksijen gazı sıkça kullanılır. Ayrıca çelik üretiminde, kaynak yapımında, suyun saflaştırılmasında ve beton eldesinde de oksijen kullanılır. Paslanma da, oksijenin varlığında gerçekleşir.
Flor ve bileşikleri, uranyum başta olmak üzere, çok sayıda ticari kimyasalın üretiminde kullanılır.
Birçok bileşiğin yapısına giren karbon, sıvı yağların dehidrasyonunda (sudan arındırılmasında), ayrıca demir ve alaşımlarının işlenmesinde kullanılır.
7. Azot (N):
9. Flor (F):
Bunları Biliyor muydunuz ?
Günümüzde 120’ye yakın elementin var olduğu bilinmektedir. Yaklafl›k 100 element yeryüzünde doğal hâlde bulunur. Geri kalanı laboratuvarlarda elde edilmiştir. Bilimsel çalışmaların sonucunda bu sayılar değişebilir.
Bilimsel çalışmalar sırasında elementleri adlarıyla kullanmak iletişimi zorlaştırır, ayrıca zaman kaybına da yol açar. Bilim insanları bu problemi ortadan kaldırmak için elementleri daha kısa şekilde ifade etmenin yollarını
aramışlardır. Ortak bir dil sa¤lamak ve kısa zamanda çok şey anlatmak için çeşitli işaretlerden yararlanmışlardır. Bu durum, hayatımızın birçok alanında karşımıza çıkar.
Örne¤in, yandaki trafik işaretlerinde anlatılanlar yazıyla yazılmış olsaydı ne gibi sakıncalar meydana gelirdi?
Elementlerin adları da eski dönemlerde çeşitli işaretlerle ifade edilmiş, daha sonra
bir sistematik geliştirilmiştir. Bilim insanları elementlerin Latince adlarının yerine bu adların ilk harflerini tercih etmişler ve bu harfler elementlerin sembolü olarak kullanılmıştır. Bazı elementler iki harfle gösterilmiştir. Çünkübu elementlerin baş harfleri bazı elementlerle aynıdır. Bu durumda o elementin ikinci harfiveya adının başka bir harfi kullanılır. ‹ki harfle belirtme durumunda ilk harf büyük, ikinci harfküçük yazılmıştır. Söz gelişi hidrojen elementinin Latince ad› “Hydro-genes” oldu¤u içinsembolü “H”, helyum elementinin Latince ad› “Helios” ve sembolü “He” şeklindedir. Fosforelementinin Latince adı “Phosphoros” olduğu için bu element “P” ile gösterilmektedir.Bakır elementinin Latince adı “Cuprum”, sembolü “Cu”, altın elementinin Latince adı“Aurum”, sembolü “Au”, sodyum elementinin Latince adı “Natrium”, sembolü “Na” vekarbon elementinin Latince ad› “Carboneum”, sembolü “C”dir.
Adı Sembol Adı Sembol
| 1-Hidrojen | H | 11-Sodyum | Na | |||
| 2-Helyum | He | 12- Magnezyum | Mg | |||
| 3-Lityum | Li | 13- Alüminyum | Al | |||
| 4-Berilyum | Be | 14- Silisyum | Si | |||
| 5-Bor | B | 15-Fosfor | P | |||
| 6-Karbon | C | 16- Klor | Cl | |||
| 7-Azot | N | 17-Potasyum | K | |||
| 8-Oksijen | O | 18-Krom | Cr | |||
| 9-FlorNeon | FNe | 19-Demir | Fe | |||
| 10Neon | Ne | 20-Nikel | Ni | |||
Elementin Dilinden
Aynı atomlar toplanıncaOluştu yeni ve saf bir madde.
Koyduk adımızı,
Helyum, hidrojen, oksijen.
Olduk hepimiz farklı element.
Çünkü her birimizin atomları,
Farklıydı di¤erinden.
Herkes anlasın diye her dilde,
Kısalttık adımızı sembolle.
Biz kısaca Cl, Mg, Fe
Ama sen bana uzun uzun
Klor, magnezyum, demir de.
Adresimiz belli,
Yerleştik hepimiz bir çizelgeye
Kullandığımız elementlerin sembolleri ülkelerin farklı dilleri ve alfabeleri olmasına rağmen dünyanın her yerinde aynıdır. Element sembollerinin dünyanın her yerinde aynı olması ortak bir bilim dili oluşturarak bilimsel iletişimi kolaylaştırmıştır. şekillerde görülen çizelgede ve metinde farklı alfabeler kullanılmasına rağmen elementlerin sembolleri aynı şekilde gösterilmektedir
Keşfedilen elementlerin sayısı arttıkça, bilim insanları elementleri belirli özelliklerine göre sınıflandırma ve periyodik sistem adı verilen bir çizelgeye yerleştirmişlerdir.
2-Atomun Yapısı
Elementlerin tüm özelliğini gösteren en küçük parçasına atom denir.
Atomu oluşturan parçacıklar farklı yüklere sa-hiptir. Atomda bulunan yükler; negatif yükler ve pozitif yüklerdir. Atomu oluşturan parçacıklar:
* Cisimden cisme elektrik yüklerini taşıyan negatif(-) yüklü elektron,
* Elektronların yükünü dengeleyen aynı sayıda ama pozitif(+) yüklü olan proton,
* Elektrik yükü taşımayan nötr parcacık nötron.
Atom iki kısımdan oluşur :
1-Çekirdek (merkez) ve 2-Katmanlar (yörünge; enerji düzeyi)
Çekirdek, hacim olarak küçük olmasına karşın, atomun tüm kütlesini oluşturur. Çekirdekte proton ve nötronlar bulunur. Elektronlar ise çekirdek çevresindeki katmanlarda bulunur.
Atomu oluşturan parçacıklar farklı yüklere sa-hiptir. Atomda bulunan yükler; negatif yükler ve pozitif yüklerdir. Atomu oluşturan parçacıklar:
* Cisimden cisme elektrik yüklerini taşıyan negatif(-) yüklü elektron,
* Elektronların yükünü dengeleyen aynı sayıda ama pozitif(+) yüklü olan proton,
* Elektrik yükü taşımayan nötr parcacık nötron.
Atom iki kısımdan oluşur :
1-Çekirdek (merkez) ve 2-Katmanlar (yörünge; enerji düzeyi)
Çekirdek, hacim olarak küçük olmasına karşın, atomun tüm kütlesini oluşturur. Çekirdekte proton ve nötronlar bulunur. Elektronlar ise çekirdek çevresindeki katmanlarda bulunur.
Atomun bir alt parçacığı olan elektronlar çekirdeğin etrafında sabit bir yerde durmaz.Elektronların hareketini fotoğrafta gördüğümüz Lunapark’taki ahtapotun yaptığı dönme hareketine benzetebiliriz. Elektronlar çekirdekten belirli uzaklıklarda hem kendi etraflarında hem de çekirdeğin etrafında çok hızlı hareket eder. Bu sebeple elektronlar çekirdeğe düşmez, çekirdek tarafından çekildikleri için de dışarı fırlamaz. Çekirdekte
bulunan proton ve nötron ise elektrona göre oldukça yavaş hareket eder.

Atomun çekirdeğinde bulunan proton ve nötronun kütlesi hemen hemen birbirine eşittir. Elektronun kütlesi ise proton ve nötronun kütlesinden çok daha küçüktür. Protonun veya nötronun kütlesi, elektronun kütlesinin yaklaşık olarak 2000 katı kadardır. Bu durumda atomun kütlesinin yaklaşık olarak proton ve nötron kütleleri toplamı olduğunu söyleyebiliriz. şimdi biz de atomu oluşturan parçacıkları kapladıkları hacme göre
karşılaştıralım.
Yanda gördüğümüz resimde olduğu gibi bu tür oyuncaklar birbirinin içine geçerek büyük bir bebek olarak görünür.
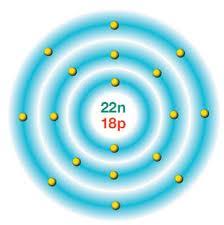
Elektronlar öncelikle çekirdeğe en yakın katmanda bulunur. ikinci katmanda sekiz elektron yer aldıktan sonra elektronlar üçüncü katmana yerleşir.
Bir elementin tüm atomlarının çekirdeğinde aynı sayıda proton bulunur. Fakat aynı elementin tüm atomlarının nötron sayıları birbirinden farklı olabilir. Proton sayısının farklı
İlk 20 Elemente Ait Atom Modelleri

Bir elementin atomunun diğer elementin atomundan farklı olması çekirdekte bulunan proton sayısına bağlıdır. Örneğin, hidrojen atomunun çekirdeğinde bir proton bulunmasına karşılık, azot atomunun çekirdeğinde yedi proton bulunmaktadır. Bu sebeple hidrojen atomu, azot atomundan farklıdır. Farklı elementlerin atomları aynı sayıda elektron veya nötron içerebilir. Ancak farklı atomların proton sayıları hiçbir zaman aynı olamaz. Bu sebeple atomda bulunan protonların sayısı, o elementin kimliğini belirler. Nötr atomlarda elektron sayısı proton sayısına bağlı olduğu için proton sayısı kadar elektron bulunur. şekilde gördüğümüz karbon atomunu incelediğimizde, çekirdeğinde altı proton ve altı nötron bulunduğunu ve altı elektrona sahip olduğunu fark ederiz.

ETKİNLİK YAPALIM
Haydi Atom Olalım
Atomun parçacıklarını temsil ederek bir atomu oluştursaydık bize düşen görevler neler olurdu? Aldığımız kararlar doğrultusunda bize düşen rol için yapmamız gerekenleri araştırarak defterimize not edelim. Rollerimizi canlandırmak için sınıfta uygun bir ortam hazırlayalım.
Bunları Yapalım
• Kaç protonu, nötronu ve elektronu olan bir atom modelini canlandırmaya karar
verdik?
• Proton, nötron ve elektronu temsil eden arkadaşlarımız atom modelimizin hangi
kısımlarında yer aldı?
• Rollerimizi canland›r›rken s›n›f›m›zda çekirdeğin ve elektronların bulundukları yeri
tebeşirle çizelim.
• Canlandırdığımız bu model hangi elemente ait bir atomu temsil etmektedir?
• Proton, nötron veya elektronu temsil ederken neleri göz önünde bulundurduk?
• Rollerimizi oynarken elektron, proton ve nötronun hareketleri nasıldı?
• Rollerimizi canland›r›rken s›n›f›m›zda proton ve nötronların yer aldığı hacim ile
elektronların yer aldığı hacimleri karşılaştıralım.
• Canlandırdığımız atom modelinin nötr bir atom olduğunu söyleyebilir miyiz? Atom
modelimizin nötr olup olmadığını nasıl ispatlarız?
• Modelimizdeki elektron, proton ve nötron hangi yüke sahiptir?
Atom Modelinin Serüveni
Atomlar tek tek tartılamaz, doğrudan incelenemez, duyu organlarıyla fark edilemeyecek kadar da küçüktür. Üstelik atomları günümüzde kullanılan en gelişmiş mikroskoplarla bile göremiyoruz. Peki, göremediğimiz atomlarla ilgili bu kadar çok bilgiyi nasıl biliyoruz? Bilim insanlar›, varlığını bildikleri ama göremedikleri atom hakkında dolayl› yollardan bilgi sahibi olmaya çalışmışlardır. Bu dolaylı bilgilere deneyler yaparak ulaşmışlar, elde ettikleri bilgileri açıklamak için çeflitli bilimsel modeller ileri sürmüşlerdir. Her yeni model, bilimin gelişmesinde bir basamak olmufltur. Yeni deneylerin sonuçlar›n›n açıklanmasında yetersiz kaldığında model geliştirmişler veya yenisi ile değişltirilmişltir. Bilimsel modeller gerçeğe bire bir uymayabilir, fakat gözlenen olguları açıkladığı sürece ve açıkladığı ölçüde geçerliliğini korur.
Element ve Atomları Kavramak için İlgili videoyu izleyebilirsiniz:
 Thomson Atom Modeli :
Thomson Atom Modeli :
(1902) üzümlü kek şeklindeki atom modeli;
Thomson atom altı parçacıklar üzerinde çalışmalar yaparken icat ettiği katot tüpü yardımıyla 1887 yılında elektronu keşfinden sonra kendi atom modelini ortaya attı. Thomson'a göre Atom dışı tamamen pozitif yüklü bir küre olup ve negatif yüklü olan elektronlar ise kek içerisindeki gömülü üzümler gibi bu küre içerisine gömülmüş hâldedir.
Rutherford Atom Modeli:
(1911) güneş sistemine benzeyen atom modeli;
Thomson'm modeline pek inanmayan Rutherford ünlü alfa saçılması deneyi ile kimya tarihine nükleer atom kavramım sokarak yeni çığır açmıştır.
Bohr Atom Modeli:
Bohr'a göre elektronlar çekirdeğin çevresinde istedikleri gibi dolaşmazlar. Çekirdeğe belirli uzaklıklardaki katmanlarda döner.Bu açıklamalarımla Nobel fizik ödülünü kazandı.Bohr atom modeli:
Eski atom modelleri günümüzde terk edilmesine rağmen bu modeller olmasaydı belki de şu anki sahip olduğumuz bilgiye ulaşamayacaktık. Bohr Atom Modelinden sonra günümüzde geçerli olan Modern Atom Teorisi’ne dayalı olarak yeni bir atom modeli geliştirilmiştir. Ancak Bohr Atom Modeli, elektron ile ilgili baz› olgular› daha somut açıkladığı için günümüzde kullan›lmaya devam edilmektedir. Günümüzde geçerli olan model, bugün atomla ilgili problemlerimizi çözebiliyor olmasına rağmen belki de gelecekte yerini yeni modellere bırakacaktır.
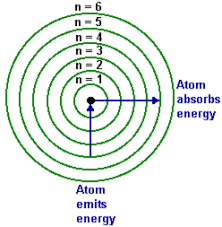 Modern Atom Teorisi
Modern Atom Teorisi
Günümüzde atom hakkında çok daha fazla bilgiye sahibiz. Çekirdekte protonun yalnız olmadığını ve “nötron” adında bir parçacıkla birlikte bulunduğunu biliyoruz. Peki,çekirdek etrafında bulunan elektronlar katmanlarda oldukları yerde mi hareket ederler?
Modern atom teorisine göre elektronlar çok hızlı hareket ettikleri için sabit bir yerleri yoktur. Bu teoriye göre katman kavramından bahsedemiyoruz. Elektronların yerlerini kesin olarak tespit edememekle birlikte yalnızca nerelerde bulunabileceklerini biliyoruz.Bu olayı şu şekilde açıklayabiliriz:Evinizde bir kedi olduğunu düşünün. Evde değilseniz kedinin nerede olduğunu bilemezsiniz,ancak nerelerde olabileceğini tahmin edersiniz.
Atomların katmanlarında belirli sayılarda elektron bulunmaktadır. Ancak bir atom, tek katmanlıysa ve bu katmanda iki elektronu varsa kararlıdır. Atomun iki katmanı varsa ve son katmanında sekiz elektron bulunuyorsa ya da üç katmanlı ise ve son katmanında yine sekiz elektronu bulunuyorsa bu tür atomlar da kararlı yapıya sahiptir.Etkinlikte, modellerini yaptığımız helyum, neon, argon gibi element atomları
katmanlarında hedeflenen sayıda elektron bulundurdukları için kararlı yapıdadır
Bir atom tek katmana sahipse ve katmandaki elektron sayısını 2’ye tamamlamışsa Dublet Kuralı’na, birden fazla katmana sahipse ve son katman›ndaki elektron sayısını 8’e tamamlamışsa Oktet Kuralı’nı gerçekleştirmiş olur.Atomlar, elektron alarak veya vererek kararlı atomların elektron dizilimine ulaştıklarında iyon olarak adlandırılır. Örneğin, dokuz proton ve dokuz elektrona sahip olan flor atomunu ele alalım.

ve Oktet Kural›’na uyarak son katmanındaki elektron sayısını sekize tamamlayacaktır.

Flor iyonunda negatif yük sayısı pozitif yük sayısından fazla olduğu için bu iyon negatif yüklüdür.Atomlar elektron aldığında negatif yükle yüklenerek iyon hâline gelirler. Negatif yüklü bu iyonlar, anyon olarak adlandırılır. Bir iyonda negatif yük sayısı pozitif yük sayısından ne kadar fazla ise o sayı, sahip olduğu yükle birlikte atomun sembolünün sağ üst köşesine yazılır. Örneğin, bir tane elektron alan flor atomu F- şeklinde gösterilir. Bir elektron (-) olarak ifade edildi¤i için gösterimlerde “1” kullanılmaz. Fakat iki elektron alm›fl bir atomun yükü “2-” şeklinde gösterilir. Flor atomu elektron alarak F- durumuna geldiğinde bu iyon
flor anyonu olarak adlandırılır.
Atomlar elektron vererek pozitif yüklü iyon hâline gelir. Pozitif yüklü bu iyonlar katyon olarak adlandırılır.
Katyonlarda pozitif yük sayısın›n negatif yük sayısından ne kadar fazla olduğu bulunur ve fazla olan yük say›s› ise, sembolün sağ üst köşesine yazılır. Örneğin, sodyum katyonunda pozitif yük sayısı negatif yük sayısından bir fazla olduğu için, sahip olduğu bu fazla yük Na+ şeklinde gösterilir. Sodyum atomu elektron vererek Na+ durumuna geldiğinde bu iyon sodyum katyonu olarak adlandırılır.
Na 1 elektron vererek Na+ durumuna gelir.
Kararlı atomlar›n elektron dizilimine sahip olmayan atomlar, kararl› atomlar›n elektron dizilimine sahip olduktan sonra anyon veya katyon hâline gelir. ‹yonlar, her zaman tek atomlu olmayabilir. Birden fazla atom grup hâlinde negatif ya da pozitif yüke sahip olur.Bu gruplara çok atomlu iyon denir
.
Yandaki çizelgede çok atomlu iyonlar, formülleri ile birlikte yer almaktad›r. Bazı maddeler atom veya moleküllerden oluşurken bazı maddeler ise atomların elektron alması ve vermesi sonucu oluşan iyonlardan meydana gelir. Örneğin, demir elementi atomlardan, iyot elementi moleküllerden,
sodyum klorür ise iyonlardan oluşmaktadır.
Kimyasal bağ, çekirdekteki atomları bir arada tutan kuvvettir. İki ya da daha fazla atom arasında elektron alışverişi veya ortak kullanımı ile kimyasal bağlar oluşmaktadır. Atomlar tek başına bulunduklarında daha düşük enerjili duruma ( daha kararlı ) erişmek için bir araya gelirler ve kimyasal bağlar sayesinde atomlar birarada, düzenli hale geçerler.
Çevremizde gördüğümüz maddeler elementlerle sınırlı değildir. Farklı element atomlarının birbirleriyle etkileşmeleri sonucunda, farklı kimyasal özelliklere sahip, yeni maddeler oluşur. Bu maddeler oluşurken atomlar arasında bağlar meydana gelir. Örneğin, yemeklerimizde kullandığımız tuz bir bileşiktir. Tuz, sodyum ve klor elementlerinden oluşan iyonların bir araya gelmeleri sonucunda oluşur. Tuzun nasıl oluştuğunu, sodyum ve klor atomlarından oluşan iyonların birbirlerine nasıl yakınlaştıklarını, elektron dizilim
modelleri üzerinde inceleyelim.
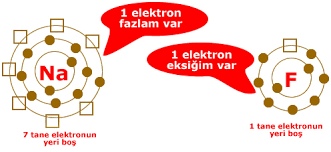
 Nötr hâlde 11 elektronu olan sodyum atomunun ilk katmanında 2, ikinci katmanında 8 ve üçüncü katmanında ise 1 elektronu vardır.
Nötr hâlde 11 elektronu olan sodyum atomunun ilk katmanında 2, ikinci katmanında 8 ve üçüncü katmanında ise 1 elektronu vardır.
Sodyum atomu, son katmanında bulunan 1 elektronunu verirse kararlı atomların elektron dizilimine
ulaşır.
Nötr hâlde 17 elektronu olan klor atomunun ilk katmanında 2, ikinci katmanında 8 elektron vardır. Bu atomun son katmanında ise 7 elektron bulunmaktadır.Klor atomu, son katmanına 1 elektron alırsa kararlı atomların elektron dizilimine ulaşır.
Klor atomu, sodyum atomunun son katmanındaki bir elektronu alarak negatif yükle yüklenir. Böylece klor anyonu oluşur. Sodyum atomu ise bir elektronu eksildiği için pozitif yükle yüklenerek sodyum katyonunu oluşturur. Oluşan anyon ve katyon zıt yüklere sahip oldukları için birbirini çeker. Anyon ve katyon arasındaki bu çekim kuvveti bir kimyasal bağdır ve bu kimyasal bağ iyonik bağ olarak adlandırılır. iyonik bağ içeren yapılarmoleküllerden oluşmaz, iyonlardan oluşur
İyonik bağ, sadece bir sodyum iyonu ve bir klor iyonu arasında gerçekleşmez. Her bir iyon, zıt yüklü iyonlar tarafından sarılır ve yığınlar oluşur. Örneğin tuzun yapısında sodyum iyonları klor iyonları ile; klor
iyonları ise sodyum iyonları ile sarılmıştır ve bu iyonlar yığın hâlini almıştır.Böylece klor ve sodyum elementlerinden tamamen farklı kimyasal özelliklere sahip yeni bir madde oluşur. Sodyum klorür olarak adlandırılan bu yeni madde günlük hayatımızda kullandığımız yemek tuzudur.
Atomlar arasındaki kimyasal bağ, her zaman elektron alışverişi ile oluşmaz. Elektron almaya yatkın atomlar, elektronlarını ortaklaşa kullanarak da birbirleri ile bağ oluşturabilir.Bu tür bağlar:

Bir başka örnek:
Atomlar, kimyasal bağ oluştururken elektron alabilir, elektron verebilir veya elektronları ortaklaşa kullanabilirler. Atomlar arasında elektron ortaklaşmasıyla kimyasal bağ gerçekleştiğinde moleküller oluşur. Kovalent bağlı yapılar molekülü oluştururken,iyonik bağlı yapılarda moleküllerden bahsedemeyiz.
Atomlar arasında elektron alışverişi veya elektron ortaklaşması gerçekleşmezse kimyasal bağ da oluşmaz.
Farklı element atomları uygun flartlarda bir araya geldiğinde yeni maddeler oluşur.
Bileşikler, kendilerini oluşturan elementlerden tamamen farklı fiziksel ve kimyasal özelliklere sahiptir. Örneğin, yemek tuzu kendisini oluşturan sodyum ve klor elementlerinden tamamen farklı özelliktedir. Sodyum elementi sadece sodyum atomlarından oluşur,gümüş rengindedir ve bıçakla kesilebilecek kadar da yumuşak bir maddedir.Sadece klor moleküllerinden oluşan klor elementi ise sarı yeşil renkli zehirli bir gazdır.Sodyum ve klorun oluşturduğu sodyum klorür bileşiği ise şeffaf, katı ve ufalanabilen özelliklere sahip olan ve hayatımızın temel ihtiyaç maddelerinden birini oluşturan yemek tuzudur.
Örneğin, su, su moleküllerinden oluşmaktadır ve
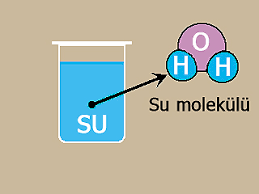 suyu oluşturan hidrojen ve oksijen atomları arasında kovalent bağ vardır. Suda olduğu gibi bileşikler moleküllerden meydana geliyorsa bu tür bileşikler molekül yapılı bileşik olarak adlandırılır.
suyu oluşturan hidrojen ve oksijen atomları arasında kovalent bağ vardır. Suda olduğu gibi bileşikler moleküllerden meydana geliyorsa bu tür bileşikler molekül yapılı bileşik olarak adlandırılır.
Bileşiklerin hepsinin moleküler yapıda olmayabilece¤ini de ö¤renmifltik. Aşağıda verilen modelleri incelediğimizde, bu bileşiklerde moleküllerin bulunmadığını, iyonların düzenli bir yığın oluşturarak bileşiği meydana getirdi¤ini fark ederiz. Örneğin, oksijen ve kalsiyum iyonları düzenli bir örgü oluşturarak kalsiyum oksit bileşiğini meydana getirir. Bu bileşik, kireç taşlarında ve bazı mermer çeflitlerinde bulunmaktad›r. Benzer şekilde sodyum iyodür bileşiği de sodyum ve iyot iyonlarının meydana getirdi¤i örgüden oluşur.
Bu bileşik, tıp alanında hastal›klar›n teflhisinde ve baz› hastal›klar›n tedavisinde ilaç olarak kullanılmaktadır.
Moleküler yapıda olmayan bileşikleri oluşturan atomlar arasında iyonik bağ vardır. Bu tür bileşikler iyonik yapılı bileşik olarak adlandırılır. Örneğin, kalsiyum oksit bileşiğinde kalsiyum ve oksijen iyonları arasında, sodyum iyodür bileşiğinde ise iyot ve sodyum iyonları arasında iyonik bağ bulunmaktadır. iyonların bağ yapması sonucunda oluşan bileşikler,iyonik bileşik olarak adlandırılır.
Bileşikler içerdikleri elementlere göre adlandırılır. Bileşikleri formüllerle göstermek için element sembollerini kullanırız. Her bileşik kaç element içeriyorsa o kadar sayıda element sembolü formülde yer alır.

Şekildeki karbon dioksit bileşiğinin modelini inceleyelim.
Yukarıdaki modele baktığımızda bu molekülün karbon ve oksijen elementlerinden oluştuğunu fark ederiz. Modelde iki oksijen atomu ve bir karbon atomu yer almaktadır.Bu sebeple bileşiğin formülünü yazarken bileşiği oluşturan en küçük birimin içerdiği elementlerin sembolleri ve atom sayısı belirtilir. ‹ncelediğimiz modeldeki karbon dioksit molekülü “CO2” formülü ile gösterilir. Bu formül bize bir tane karbon (C) atomu ile iki tane oksijen (O) atomunun bir araya gelerek karbon dioksit (CO2) bileşiğini oluşturduğunu gösterir. Bileşiklerin formüllerine bakarak bu moleküllerin hangi elementlerden oluştuğunu ve kaç atom içerdiğini anlayabiliriz.
Etkinliğimizde çeşitli element ve bileşikleri inceledik. Elementler tek çeşit atom içerirken, bileşikler en az iki farklı element atomundan oluşmaktadır.Bu konuda farklı element atomlarının kimyasal bağ oluflturmalarIyla yeni ve saf maddelerin meydana geldi¤ini fark ettik ve oluflan bu yeni maddeleri bileşik olarak adlandırdık.
Karışım, birden çok maddenin kimyasal bağ oluşturmadan bir arada bulunmasıyla meydana gelir. Karışımlar yeni ve saf madde de¤ildir. Bu sebeple karışımların belirli bir kimyasal formülü yoktur. Birçok karışımın hangi maddelerden meydana geldiğini bile kimi zaman bilmeyiz. Örneğin, kahve ve çay gibi maddeler belirli bir kimyasal formül ile ifade edilemez. Çünkü kahvenin ya da çayın içerdiği element ve bileşiklerin miktarları
yetiştirildikleri toprağa göre farklı olacaktır
Karışımlar görünümlerine göre ikiye ayrılır. Örneğin, tebeşir tozu ile suyu karıştırdığımızda tebeşir karışımın her tarafında aynı miktarda bulunmaz.
Tebeşir tozu karışımın üst tarafında daha çok diğer kısımlarında ise daha az miktarlarda bulunur.Karışımı oluşturan maddeler karışımın her tarafına eşit miktarlarda dağılmıyorsa bu tür karışımlara heterojen karışım adı verilir.
Karışımı oluşturan maddeler karışımın her tarafına eşit olarak dağılmışsa bu tür karışımlar homojen karışımlardır. Çözeltiler homojen karışımlardır. Örneğin, bir miktar şeker ile suyu karıştırdığımızda şeker ile su karışımın her tarafında eşit oranda bulunur.
 Çıplak gözle bakıldığında homojen gibi görünen baz› karışımların, mikroskopla bakıldığında heterojen olduğu gözlenir.Örneğin, mineral ve vitamin gibi besinler içeren süt çıplak gözle bakıldığında homojen gibi görünür. Mikroskopta incelendiği zaman ise yağ zerreciklerinin belirli kısımlarında daha fazla bulunduğu görülür ve sütün heterojen olduğu anlaşılır.
Çıplak gözle bakıldığında homojen gibi görünen baz› karışımların, mikroskopla bakıldığında heterojen olduğu gözlenir.Örneğin, mineral ve vitamin gibi besinler içeren süt çıplak gözle bakıldığında homojen gibi görünür. Mikroskopta incelendiği zaman ise yağ zerreciklerinin belirli kısımlarında daha fazla bulunduğu görülür ve sütün heterojen olduğu anlaşılır.
Günlük hayatta çözelti adını kullanmasak bile çözeltilerle iç içe yaşıyoruz.Soluduğumuz hava, içerisinde
bazı canlıların yaşadığı sular, içtiğimiz meşrubatlar, diş dolgusunda kullanılan amalgamlar, kullandığımız
metal paralar, hepsi birer çözeltidir.
Bu çözeltileri oluşturan maddelerden miktarı çok olan çözücü, az olan da çözünen olarak adlandırılır. Fakat sulu çözeltilerde suyun miktar› az bile olsa su çözücü olarak kabul edilmektedir. Örneğin, bir bardak suya bir kaşık şeker eklenerek hazırlanan çözeltide, su çözücü, şeker ise çözünen maddedir.
Çözeltiler fiziksel hâllerine bağlı olarak katı, sıvı veya gaz hâlde bulunur.
Çözelti oluşurken çözücü ve çözünen maddeler arasında bir etkileşim olur. Çözünen maddenin tanecikleri çözücü ile etkileşerek birbirinden ayrılır ve çözücünün her tarafına dağılır. Bu dağılma sırasında çözücünün tanecikleri çözünenin taneciklerinin etrafını sarar. Böylece çözücü ve çözünen maddeler en küçük birimine kadar ayrılır. Çözünme, çözücü ve çözünen maddelerin birbiri içinde iyonlarına veya moleküllerine ayrılmasıdır. şekilde kırmızı renkle gösterilen çözücü maddenin tanecikleri ile mavi renkle gösterilen çözünen
maddenin taneciklerinin çözeltideki durumları gösterilmektedir.
Şekeri suya eklemeden önce, şekeri oluşturan moleküller birbirine çok yakındır.şekilde de görüldü¤ü gibi, şeker suya eklenince suyu oluşturan moleküller, şekeri oluşturan moleküllerin arasına girerek şeker moleküllerinin etrafını sarar. Böylece sıkı hâlde dizilmiş duran şeker molekülleri birbirinden ayrılır.şekerin tamamı çözününce su da şeker de moleküllerine kadar ayrılmış olur.
Tuz suda, şekerin suda çözünmesinden daha farklı bir şekilde çözünür. Çünkü şeker moleküler yapılı bir bileşik iken tuz iyonik yapılı bir bileşiktir.Tuz suya eklenmeden önce sodyum ve klor iyonları düzenli bir yığın hâlinde birbirlerinin etrafında bulunurken suya eklendiğinde bu iyonlar aşağıdaki şekilde de görüldüğü gibi
birbirinden ayrılır. Çünkü su molekülleri, klor ve sodyum iyonlarının arasına girerek bu iyonların etrafını sarar. Tuzun tamamı çözündükten sonra tuzu oluşturan sodyum ve klor iyonları ile suyu oluşturan moleküller çözeltinin her tarafında aynı oranda bulunur.
Tuzlu su elektrik ak›m›n› ilettiği için ampul ışık verir. Çünkü tuz suda çözünürken iyonlarına ayrılmıştır. iyonlar yüklü oldukları için elektrik ak›m›n› iletmiş ve ampul ışık vermifltir. Tuzun suda çözünmesinde olduğu gibi, çözündüğü zaman iyonlarına ayrılan iyonik bileşiklerin suda çözünmeleri ile oluşan çözeltilere elektrolit çözeltiler denir. Şekerli suda olduğu gibi elektrik akımını iletmeyen çözeltiler elektrolit olmayan çözelti olarak adlandırılır.
Etkinliğimizde şekerli su ve su, elektriği iletmedikleri için ampul ışık vermemiştir.Çünkü şeker ve su moleküler yapıdadır. Çözeltide şeker ve su moleküllerine ayrılır ve moleküller yüksüz olduğu için elektrik akımını iletemez.
Çözelti oluştururken çözünen maddenin çözücüde daha hızlı çözünmesi için sıcaklığı artırabilir veya çözünen maddenin tane boyutunu küçültebiliriz
.Çözelti oluştururken sıcaklığı artırmak çözücü ve çözünen maddenin taneciklerinin çarpışmasını hızlandıracaktır. Bu durumda çözücünün tanecikleri çözünenin taneciklerini daha hızlı kuşatacak ve çözünme daha kısa sürede gerçekleşecektir.Aynı şekilde çözünen maddeleri ufalayarak tane boyutunu küçülttüğümüzde,çözücünün taneciklerinin daha çok çözünen madde tanecikleriyle temas etmesi sağlanmış olacaktır.
• Çözelti seyreltik hale getirilirken çözücü miktarı artmasına rağmen çözünen miktarı değişmez.
https://docs.google.com/presentation/d/1iH_VphEkSW5Yse6BUF-VPe89udcIEdPn0VvOO_ch9Wk/edit#slide=id.p43
Atomun çekirdeğinde bulunan proton ve nötronun kütlesi hemen hemen birbirine eşittir. Elektronun kütlesi ise proton ve nötronun kütlesinden çok daha küçüktür. Protonun veya nötronun kütlesi, elektronun kütlesinin yaklaşık olarak 2000 katı kadardır. Bu durumda atomun kütlesinin yaklaşık olarak proton ve nötron kütleleri toplamı olduğunu söyleyebiliriz. şimdi biz de atomu oluşturan parçacıkları kapladıkları hacme göre
karşılaştıralım.
| Tanecik adı | Sembol | Elektrik yükü | Kütle (kg) |
| Proton | P+ | + | 1,6725.10-27 kg |
| Elektron | e- | - | 9,107.10-31 kg |
| Nötron | n0 | 0 | 1,6748.10-27 kg |
Bunları Biliyor muydunuz ?
Eğer atomun çekirdeği bir bilye büyüklüğünde lsaydı atom yaklafl›k olarak bir stadyum büyüklüğünde olurdu. Bu durumda elektronların hareket ettikleri bölgenin, çekirdeğe göre ne kadar çok yer kapladığını hayal edebiliyor
musunuz?
Yanda gördüğümüz resimde olduğu gibi bu tür oyuncaklar birbirinin içine geçerek büyük bir bebek olarak görünür.
Elektronlar öncelikle çekirdeğe en yakın katmanda bulunur. ikinci katmanda sekiz elektron yer aldıktan sonra elektronlar üçüncü katmana yerleşir.
Bir elementin tüm atomlarının çekirdeğinde aynı sayıda proton bulunur. Fakat aynı elementin tüm atomlarının nötron sayıları birbirinden farklı olabilir. Proton sayısının farklı
olması ise elementin farklı olması demektir.
İlk 20 Elemente Ait Atom Modelleri
Bir elementin atomunun diğer elementin atomundan farklı olması çekirdekte bulunan proton sayısına bağlıdır. Örneğin, hidrojen atomunun çekirdeğinde bir proton bulunmasına karşılık, azot atomunun çekirdeğinde yedi proton bulunmaktadır. Bu sebeple hidrojen atomu, azot atomundan farklıdır. Farklı elementlerin atomları aynı sayıda elektron veya nötron içerebilir. Ancak farklı atomların proton sayıları hiçbir zaman aynı olamaz. Bu sebeple atomda bulunan protonların sayısı, o elementin kimliğini belirler. Nötr atomlarda elektron sayısı proton sayısına bağlı olduğu için proton sayısı kadar elektron bulunur. şekilde gördüğümüz karbon atomunu incelediğimizde, çekirdeğinde altı proton ve altı nötron bulunduğunu ve altı elektrona sahip olduğunu fark ederiz.
ETKİNLİK YAPALIM
Haydi Atom Olalım
Atomun parçacıklarını temsil ederek bir atomu oluştursaydık bize düşen görevler neler olurdu? Aldığımız kararlar doğrultusunda bize düşen rol için yapmamız gerekenleri araştırarak defterimize not edelim. Rollerimizi canlandırmak için sınıfta uygun bir ortam hazırlayalım.
Bunları Yapalım
• Kaç protonu, nötronu ve elektronu olan bir atom modelini canlandırmaya karar
verdik?
• Proton, nötron ve elektronu temsil eden arkadaşlarımız atom modelimizin hangi
kısımlarında yer aldı?
• Rollerimizi canland›r›rken s›n›f›m›zda çekirdeğin ve elektronların bulundukları yeri
tebeşirle çizelim.
• Canlandırdığımız bu model hangi elemente ait bir atomu temsil etmektedir?
• Proton, nötron veya elektronu temsil ederken neleri göz önünde bulundurduk?
• Rollerimizi oynarken elektron, proton ve nötronun hareketleri nasıldı?
• Rollerimizi canland›r›rken s›n›f›m›zda proton ve nötronların yer aldığı hacim ile
elektronların yer aldığı hacimleri karşılaştıralım.
• Canlandırdığımız atom modelinin nötr bir atom olduğunu söyleyebilir miyiz? Atom
modelimizin nötr olup olmadığını nasıl ispatlarız?
• Modelimizdeki elektron, proton ve nötron hangi yüke sahiptir?
Atom Modelinin Serüveni
Atomlar tek tek tartılamaz, doğrudan incelenemez, duyu organlarıyla fark edilemeyecek kadar da küçüktür. Üstelik atomları günümüzde kullanılan en gelişmiş mikroskoplarla bile göremiyoruz. Peki, göremediğimiz atomlarla ilgili bu kadar çok bilgiyi nasıl biliyoruz? Bilim insanlar›, varlığını bildikleri ama göremedikleri atom hakkında dolayl› yollardan bilgi sahibi olmaya çalışmışlardır. Bu dolaylı bilgilere deneyler yaparak ulaşmışlar, elde ettikleri bilgileri açıklamak için çeflitli bilimsel modeller ileri sürmüşlerdir. Her yeni model, bilimin gelişmesinde bir basamak olmufltur. Yeni deneylerin sonuçlar›n›n açıklanmasında yetersiz kaldığında model geliştirmişler veya yenisi ile değişltirilmişltir. Bilimsel modeller gerçeğe bire bir uymayabilir, fakat gözlenen olguları açıkladığı sürece ve açıkladığı ölçüde geçerliliğini korur.
Element ve Atomları Kavramak için İlgili videoyu izleyebilirsiniz:
Bilim insanlarının geçmişten günümüze kadar gelişltirdikleri atom modellerini inceleyelim.
(1902) üzümlü kek şeklindeki atom modeli;
Thomson atom altı parçacıklar üzerinde çalışmalar yaparken icat ettiği katot tüpü yardımıyla 1887 yılında elektronu keşfinden sonra kendi atom modelini ortaya attı. Thomson'a göre Atom dışı tamamen pozitif yüklü bir küre olup ve negatif yüklü olan elektronlar ise kek içerisindeki gömülü üzümler gibi bu küre içerisine gömülmüş hâldedir.
Rutherford Atom Modeli:
(1911) güneş sistemine benzeyen atom modeli;
Thomson'm modeline pek inanmayan Rutherford ünlü alfa saçılması deneyi ile kimya tarihine nükleer atom kavramım sokarak yeni çığır açmıştır.
Bohr Atom Modeli:
Bohr'a göre elektronlar çekirdeğin çevresinde istedikleri gibi dolaşmazlar. Çekirdeğe belirli uzaklıklardaki katmanlarda döner.Bu açıklamalarımla Nobel fizik ödülünü kazandı.Bohr atom modeli:
Eski atom modelleri günümüzde terk edilmesine rağmen bu modeller olmasaydı belki de şu anki sahip olduğumuz bilgiye ulaşamayacaktık. Bohr Atom Modelinden sonra günümüzde geçerli olan Modern Atom Teorisi’ne dayalı olarak yeni bir atom modeli geliştirilmiştir. Ancak Bohr Atom Modeli, elektron ile ilgili baz› olgular› daha somut açıkladığı için günümüzde kullan›lmaya devam edilmektedir. Günümüzde geçerli olan model, bugün atomla ilgili problemlerimizi çözebiliyor olmasına rağmen belki de gelecekte yerini yeni modellere bırakacaktır.
Günümüzde atom hakkında çok daha fazla bilgiye sahibiz. Çekirdekte protonun yalnız olmadığını ve “nötron” adında bir parçacıkla birlikte bulunduğunu biliyoruz. Peki,çekirdek etrafında bulunan elektronlar katmanlarda oldukları yerde mi hareket ederler?
Modern atom teorisine göre elektronlar çok hızlı hareket ettikleri için sabit bir yerleri yoktur. Bu teoriye göre katman kavramından bahsedemiyoruz. Elektronların yerlerini kesin olarak tespit edememekle birlikte yalnızca nerelerde bulunabileceklerini biliyoruz.Bu olayı şu şekilde açıklayabiliriz:Evinizde bir kedi olduğunu düşünün. Evde değilseniz kedinin nerede olduğunu bilemezsiniz,ancak nerelerde olabileceğini tahmin edersiniz.
Benzer şekilde biz de atomu göremiyoruz ancak elektronun nerelerde olabileceğini tahmin ediyoruz.
Elektronun bulunabileceği ve hareket ettiği alanı,sineğin asılı lambanın çevresinde döndüğü alana
benzetebiliriz. ‹şte elektronların bulunabilecekleri bu kısımlar elektron bulutu olarak adlandırılır.
Elektron, çekirde¤in etrafında her yerde dolafl›yor olsayd› çizimimiz şekildeki gibi noktalı bir gösterime sahip olur muydu? Elektron bulutu modelinde elektronun belirli bir yörüngesi olmadığı için elektron, şekilde de gösterildiği gibi kısa süre içinde farklı konumlarda bulunur.
3-ELEKTRONLARIN DİZİLİMLERİ VE KİMYASAL ÖZELLİKLERİ
katmanlarında hedeflenen sayıda elektron bulundurdukları için kararlı yapıdadır
Tüm atomların en büyük amaçları kararlı bir yapıya ulaşmak ve bu kararlılığını korumaktır. Atomlar bileşik oluştururken karalı hale gelir. Soygazlar ise zaten karalı oldukları için bileşik yapamazlar.Soygaz olarak adlandırılan helyum, neon, argon atomları, kararlı atomların sahipolduğu elektron diziliminde olduklar› için elektron alışverişi yapmazlar. Diğer atomlar ise elektron alışverişi yaparak kararlı atomların elektron dizilimine ulaşmaya çalışırlar. Bazı atomlar elektron alarak veya vererek helyum atomunun elektron dizilimine ulaşmaya çalışırlar ve bu olgu “Dublet Kuralı” olarak bilinir. Örneğin, lityum atomu Dublet Kuralı’na uyarak son katmanındaki bir elektronu verir ve helyum atomunun elektron dizilimine sahip olur. Benzer şekilde bazı atomlar da elektron alışverişi yaparak neon veya argon atomunun elektron dizilimine sahip olmak isterler. Bu durum “Oktet Kuralı” olarak bilinir.

Yandaki modelde flor atomunun elektron dizilimini inceleyelim.
Flor atomunun kararlı atomların elektron dizilimine ulaşması için ya bir elektron
alması ya da yedi elektron vermesi gerekir. Tabii ki bir elektron alması, yedi elektron
vermesinden daha kolaydır. Bu durumda flor atomu bir elektron almayı tercih edecektir
ve Oktet Kural›’na uyarak son katmanındaki elektron sayısını sekize tamamlayacaktır.

Flor atomunun pozitif ve negatif yükleri eşit sayıda iken, bir elektron al›p iyon hâline geldikten sonra yük dengesi bozulmuştur. Flor atomu bir elektron alarak negatif yük sayısını bir tane artırmıştır.
flor anyonu olarak adlandırılır.
Atomlar elektron vererek pozitif yüklü iyon hâline gelir. Pozitif yüklü bu iyonlar katyon olarak adlandırılır.
Katyonlarda pozitif yük sayısın›n negatif yük sayısından ne kadar fazla olduğu bulunur ve fazla olan yük say›s› ise, sembolün sağ üst köşesine yazılır. Örneğin, sodyum katyonunda pozitif yük sayısı negatif yük sayısından bir fazla olduğu için, sahip olduğu bu fazla yük Na+ şeklinde gösterilir. Sodyum atomu elektron vererek Na+ durumuna geldiğinde bu iyon sodyum katyonu olarak adlandırılır.
Na 1 elektron vererek Na+ durumuna gelir.
.
sodyum klorür ise iyonlardan oluşmaktadır.
4-KİMYASAL BAĞ
modelleri üzerinde inceleyelim.
 Nötr hâlde 11 elektronu olan sodyum atomunun ilk katmanında 2, ikinci katmanında 8 ve üçüncü katmanında ise 1 elektronu vardır.
Nötr hâlde 11 elektronu olan sodyum atomunun ilk katmanında 2, ikinci katmanında 8 ve üçüncü katmanında ise 1 elektronu vardır.ulaşır.
iyonları ise sodyum iyonları ile sarılmıştır ve bu iyonlar yığın hâlini almıştır.Böylece klor ve sodyum elementlerinden tamamen farklı kimyasal özelliklere sahip yeni bir madde oluşur. Sodyum klorür olarak adlandırılan bu yeni madde günlük hayatımızda kullandığımız yemek tuzudur.
. İyonik katılar belirli bir kristal yapı oluştururlar.
. İyonik bağlı bileşikler oda sıcaklığında katı halde bulunurlar.
. İyonik bileşikler katı halde elektriği iletmez. Sıvı halde ve çözeltileri elektriği iletirler.
Kovalent Bağ: Atomlar arasında, son katmanlarda yer alan elektronlardan bazılarının ortaklaşa kullanılmasıyla oluşan bağa denir.Kovalent bağ kuran atomlar arasında ortaklaşa kullanılan elektronlar, her iki atomu da dublet ya da oktete ulaştırır. Her iki atoma da iyon diyemeyiz. Çünkü elektron almamış, vermemişlerdir.
Örneğin iki hidrojen atomu elektronlarını ortaklaşa kullanarak aralarında kovalent bağ oluşturur. Böylece her bir hidrojen atomu helyumun kararlı yapısına ulaşır.
Yandaki atomların son katmanlarında 6 elektronları vardır. Yani 2 elektron daha aramaktadırlar.İkişer elektronlarını ortaklaşa kullanarak kararlı yapıya geçerler.
Atomlar arasında elektron alışverişi veya elektron ortaklaşması gerçekleşmezse kimyasal bağ da oluşmaz.
5-BİLEŞİKLER VE FORMÜLLERİ
Bu yeni maddeleri oluşturan atomlar arasında kimyasal bağ bulunmaktadır. Farklı
elementlere ait atomların belirli oranlarda bir araya gelerek bağ yapmasıyla oluşan yeni
ve saf maddeye bileşik denir.
Örneğin, su, su moleküllerinden oluşmaktadır ve
Aşağıdaki çizelgede günlük hayatta sıkça karşılaştığımız molekül yapılı bileşiklere yer verilmiştir.
Bu bileşik, tıp alanında hastal›klar›n teflhisinde ve baz› hastal›klar›n tedavisinde ilaç olarak kullanılmaktadır.
Moleküler yapıda olmayan bileşikleri oluşturan atomlar arasında iyonik bağ vardır. Bu tür bileşikler iyonik yapılı bileşik olarak adlandırılır. Örneğin, kalsiyum oksit bileşiğinde kalsiyum ve oksijen iyonları arasında, sodyum iyodür bileşiğinde ise iyot ve sodyum iyonları arasında iyonik bağ bulunmaktadır. iyonların bağ yapması sonucunda oluşan bileşikler,iyonik bileşik olarak adlandırılır.
Bileşikler içerdikleri elementlere göre adlandırılır. Bileşikleri formüllerle göstermek için element sembollerini kullanırız. Her bileşik kaç element içeriyorsa o kadar sayıda element sembolü formülde yer alır.
 ETKİNLİK YAPALIM
ETKİNLİK YAPALIM
HANGİSİ MOLEKÜLLÜ?
Birden fazla maddenin kimyasal özellikleri degismeyecek sekilde istenilen oranda bir araya getirilmesiyle oluşur.Bugüne kadar topluluğuna karışım denir.
Karışım, birden çok maddenin kimyasal bağ oluşturmadan bir arada bulunmasıyla meydana gelir. Karışımlar yeni ve saf madde de¤ildir. Bu sebeple karışımların belirli bir kimyasal formülü yoktur. Birçok karışımın hangi maddelerden meydana geldiğini bile kimi zaman bilmeyiz. Örneğin, kahve ve çay gibi maddeler belirli bir kimyasal formül ile ifade edilemez. Çünkü kahvenin ya da çayın içerdiği element ve bileşiklerin miktarları
yetiştirildikleri toprağa göre farklı olacaktır
Tebeşir tozu karışımın üst tarafında daha çok diğer kısımlarında ise daha az miktarlarda bulunur.Karışımı oluşturan maddeler karışımın her tarafına eşit miktarlarda dağılmıyorsa bu tür karışımlara heterojen karışım adı verilir.
Ayran da heterojen karışımdır.
Günlük hayatta çözelti adını kullanmasak bile çözeltilerle iç içe yaşıyoruz.Soluduğumuz hava, içerisinde
bazı canlıların yaşadığı sular, içtiğimiz meşrubatlar, diş dolgusunda kullanılan amalgamlar, kullandığımız
metal paralar, hepsi birer çözeltidir.
Çözeltiler fiziksel hâllerine bağlı olarak katı, sıvı veya gaz hâlde bulunur.
maddenin taneciklerinin çözeltideki durumları gösterilmektedir.
birbirinden ayrılır. Çünkü su molekülleri, klor ve sodyum iyonlarının arasına girerek bu iyonların etrafını sarar. Tuzun tamamı çözündükten sonra tuzu oluşturan sodyum ve klor iyonları ile suyu oluşturan moleküller çözeltinin her tarafında aynı oranda bulunur.
 ETKİNLİK YAPALIM
ETKİNLİK YAPALIM
Çözünme Hızına Etki Eden Faktörler
1.Sıcaklık
2. Basınç (Sıvı+Gaz)
3. Karıştırmak
4. Maddenin miktarı
5. Katı maddenin temas yüzeyi
.Çözelti oluştururken sıcaklığı artırmak çözücü ve çözünen maddenin taneciklerinin çarpışmasını hızlandıracaktır. Bu durumda çözücünün tanecikleri çözünenin taneciklerini daha hızlı kuşatacak ve çözünme daha kısa sürede gerçekleşecektir.Aynı şekilde çözünen maddeleri ufalayarak tane boyutunu küçülttüğümüzde,çözücünün taneciklerinin daha çok çözünen madde tanecikleriyle temas etmesi sağlanmış olacaktır.
Çözünürlüğe etki eden faktörler ile çözünme hızına etki eden faktörlerin karşılaştırılması:
Çözünürlüğe etki eden faktörler
|
Çözünme hızına etki eden faktörler
|
1. Sıcaklık
|
1. Sıcaklık
|
2. Basınç (sıvı+gaz)
|
2. Basınç (Sıvı+Gaz)
|
3. Çözücünün cinsi
|
3. Karıştırmak
|
4. Çözünenin cinsi
|
4. Maddenin miktarı
|
5. Ortak iyon etkisi
|
5. Katı maddenin temas yüzeyi
|
 ETKİNLİK YAPALIM
ETKİNLİK YAPALIM
Etkinlikte verilen çizelgeye göre öğrencilerin bir kısmı çayı az şekerli, bir kısmı çok
şekerli içmektedir. Az şeker kullananların çayı seyreltik, çok şeker kullananların çayı
ise derişiktir
a) Seyreltik çözelti:
Çözeltilerde, (çözünen miktarının azaltılıp), çözücü miktarının arttırılmasına seyreltme denir.
• Çözeltiye (veya derişik çözeltiye) çözücü madde eklenirse seyreltik çözelti elde edilir. • Çözelti seyreltik hale getirilirken çözücü miktarı artmasına rağmen çözünen miktarı değişmez.
b) Derişik çözelti:
Çözeltilerde, çözünen miktarının arttırılıp, çözücü miktarının azaltılmasına deriştirme denir.
• Çözeltiye (veya seyreltik çözeltiye) çözünen madde eklenirse veya çözücü madde uzaklaştırılırsa derişik çözelti elde edilir.
• Çözeltiden çözücü maddenin uzaklaştırılması için çözücü maddenin buharlaştırılması (bunun için de çözeltinin ısıtılması) gerekir.
• Çözelti derişik hale getirilirken çözücü miktarı buharlaştırılarak azalmasına rağmen çözünen miktarı değişmez.
MADDENİN YAPISI VE ÖZELLİKLERİ KONUSU BİTMİŞTİR.ÖZETLERSEK:

MADDENİN YAPISI VE ÖZELLİKLERİ SUNUMU İÇİN TIKLAYIN!!!
https://docs.google.com/presentation/d/1iH_VphEkSW5Yse6BUF-VPe89udcIEdPn0VvOO_ch9Wk/edit#slide=id.p43
BAŞVURULAN KAYNAKLAR






















Doğada canlı ve cansız her madde elementlerden oluşmaktadır. Bazı elementlerin
YanıtlaSiladlar›n› besinlerimizden veya kullandığımız malzemelerden dolayı sıkça duyarız. Fakat
bunların element olup olmadıklarını herhalde bugüne kadar hiç düşünmemişizdir.
https://www.facebook.com/permalink.php?story_fbid=549081488876590&id=100013242319421
Bedenimizi oluşturan elementlerden bazıları (Oligo elementler)
https://namenstr8bredaholland.blogspot.com/2017/01/element-nedir-elementin-ozellikleri.html
Kavramına sahip olunmayan şey görülemez. Nasıl ki teleskop olmadan uzak cisimler, mikroskop olmadan küçük cisimler çıplak göz tarafından görülemez ise, aklın gözü olan, ona teleskop ve mikroskop hizmeti veren kavramlar olmadan da akıl göremez; öte bir deyişle, akıl yalnızca kavramına sahip olduğu şeyi görebilir.
https://meerstr11.blogspot.com/2017/01/akil-bu-gibi-genel-tanimlar-kisinin.html
Ben kimim, neyim, niçin varım, nereden geldim, nereye gidiyorum?
YanıtlaSilDoğada canlı ve cansız her madde elementlerden oluşmaktadır.
Hatta Kurana dilediğimizi söyletiyoruz.Olmaması için.
ALLAH,İnsanın algılama alanının kapsamı dışındadır.(Yaratıcı)
https://www.facebook.com/permalink.php?story_fbid=565610313890374&id=100013242319421